22日,三生国健(688336.SH)披露2022年年报显示,公司实现营业收入8.25亿元,归母净利润4930万元,同比增长172.99%;经营性现金流量净额达2.33亿元,年末资金存量25.8亿元,资金储备充裕。
经受住考验的2022年
2022年,中国医药产业迎来了巨大的压力和挑战。三生国健自然也难以避免。
直面现实,是勇于挑战的第一步。三生国健的解题思路是:用新的增量来对冲这些压力。
截至目前,三生国健的上市产品有三款,分别为重组人II型肿瘤坏死因子受体-抗体融合蛋白(商品名:益赛普)、伊尼妥单抗(商品名:赛普汀)、重组抗CD25人源化单克隆抗体注射液(商品名:健尼哌)。
2022年,因大环境影响,国内患者的就诊率有所下降,对于以门诊处方为主的慢病治疗药物造成不利影响,三生国健的益赛普销售受到冲击。
对此,三生国健在2022年年报中表示,益赛普仍将渠道下沉作为重要方向,着眼于地、县级市场扩大覆盖面,同时加大益赛普在中医科室的推广力度,通过重磅循证医学证据开拓市场。
另值得注意的是,益赛普水针的评审工作已全部完成,日后水针的上市将极大改善患者的依从性,相对同类产品形成差异化竞争优势。
赛普汀全力推进医院覆盖,积极推进一线用药,2022年销售收入同比增长138%,覆盖的医院终端数量超过1300家,较去年同期增加710家,并于年底成功续约国家医保,报销标准解除与长春瑞滨联合使用的限制,不限化疗方案用于晚期乳腺癌治疗。同时,赛普汀临床方面再添新证:多项临床试验分别入选ASCO和SABCS等国际顶尖学术盛会,HOPES研究亚组结果荣登《TBCR》杂志。在2022年的CSCO乳腺癌诊疗指南中,赛普汀继续保持HER2+晚期乳腺癌H敏感患者抗HER2治疗的I级推荐用药地位。
健尼哌业务同样持续增长,2022年收入同比增长45%。健尼哌是目前国内唯一获批上市的人源化抗CD25单抗,可用于预防肾移植引起的急性排斥反应,免疫原性更低且安全性更高,与常规免疫抑制方案联用,能显著提高移植器官存活率,改善患者生存质量。
值得注意的是,CDMO业务成为三生国健业务的重要补充和新增长点,2022年实现销售收入1亿元,同比增长160%。晟国医药作为公司CDMO业务的载体,拥有卓越的生物药研发和生产技术平台,可进行各种类型的药物开发,为客户提供从DNA到IND再到NDA的全流程一站式服务。自2021年底对外推出以来,晟国医药的品牌被客户逐渐认可和熟知。2022年6月,晟国医药上海张江基地凭借抗体药物研发平台和200L-5000L的产业化能力,助力客户上海津曼特顺利提交新药NDA申请,展现了高度的专业性和强大的平台综合实力。
通过赛普汀的放量和CDMO业务的崛起,2022年,三生国健的收入结构更加均衡,正逐步实现从大单品向多元化收入的转型。
聚焦优势自免赛道
面对2022年的多方挑战,三生国健的应对措施是坚持“聚焦”发展。三生国健董事长娄竞曾公开表示,2021年底在经历了前期大量的调研和充分认证后,公司对三生国健未来的发展做出调整,其中重要的一点就是聚焦,把有限的资源投入到前景和自身优势最强的领域是国健的优选,选择自免领域作为公司的聚焦方向。
根据年报,2022年公司临床团队克服多重困难,通过多种方式保障核心自免临床试验顺利推进,基本达成全年临床进展目标:608项目II期数据读出,达到临床终点,并启动III期临床;610、611、613项目均完成II期启动和首例受试者入组,其中截至年报发布日,611和613的II期临床已经完成全部受试者的入组。
“当前,公司自免项目的临床进展均处于同类国内产品前列,公司将持续加快临床进度,力争实现所有自免管线产品国内第一梯队上市的目标。”三生国健在2022年年报中表示。
目前,三生国健研发管线中共有13个产品,其中国内涉及17个临床研发项目,包括1个临床前研发项目;1个项目在申报IND;4个项目进入临床I期;7个项目进入临床II期,3个项目进入临床III期,1个项目已申报NDA。
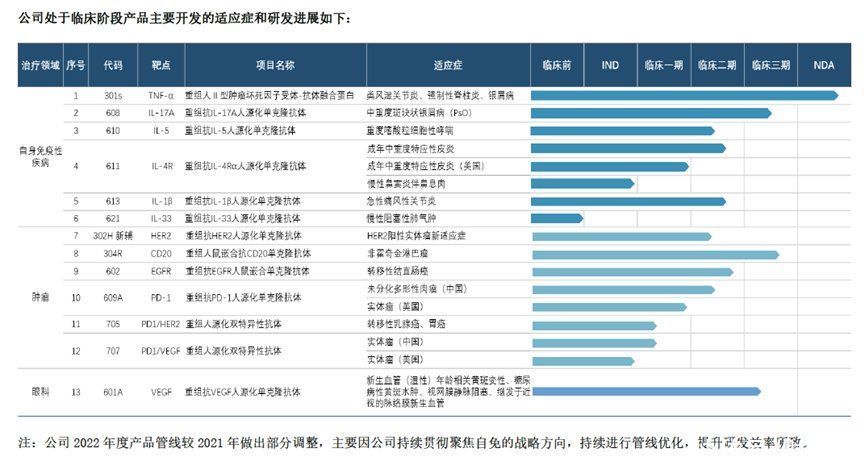
三生国健部分处于临床阶段产品2022年主要研发进展如下:
● 重组人II型肿瘤坏死因子受体-抗体融合蛋白注射液(“301S”):NDA审评中(截至目前,评审工作已经全部完成)。
● 抗IL-17A人源化单克隆抗体(“608”):获得中重度斑块状银屑病II期临床核心数据;获得中重度斑块状银屑病临床III期临床方案CDE的审批意见;获得组长单位伦理审批通过意见,并完成了首家中心的启动。
● 抗IL-5人源化单克隆抗体注射液(“610”):完成重度嗜酸性粒细胞哮喘患者的临床Ib期研究入组;完成重度嗜酸性粒细胞哮喘患者的临床II期研究启动和首例受试者入组。
● 抗IL-4Rα人源化单克隆抗体药物(“611”):完成在中重度特应性皮炎患者临床Ib期入组;完成在中重度特应性皮炎患者临床II期首例受试者入组;重新提交慢性鼻窦炎伴鼻息肉适应症的IND申请。
● 抗IL-1β人源化单克隆抗体注射液(“613”):完成在急性痛风性关节炎患者临床Ib期研究所有受试者的入组;完成在该适应症的临床II期研究的首例受试者入组。
● 抗IL-33人源化单克隆抗体注射液(“621”):Pre-IND申报准备。
这些都有望在2023年及后续的年份里,打开三生国健的新空间。从市场容量来看,展望2025年,三生国健届时的上市产品与自有管线中的几款自免产品合计峰值或将超百亿元,这也是三生国健的后劲所在。
最后,值得一提的是,三生国健同步还在海外另辟战场。2022年,公司自有产品License-out实现突破。
2022年1月,公司将研发品种609A(抗PD-1人源化单克隆抗体注射液)用于肿瘤免疫联合疗法syncrovax™的全球权益授权给美国Syncromune公司;
2022年6月,公司与成都西岭源药业有限公司全资子公司成都科岭源医药技术有限公司签署许可合作协议,将赛普汀抗体序列用于抗体偶联药物(ADC)开发和商业化的全球权益授权给科岭源,公司将有望获得包括首付款、研发里程碑付款及销售里程碑付款以及未来产品上市后的销售分成。
由此可见,三生国健已迈出转型步伐,在保持核心产品优势的同时,聚焦优势自免赛道,并选择扬帆出海。一切才刚刚开始,未来,三生国健将继续进行差异化竞争,聚焦自免这一优势领域,快速推进临床,做好短期经营与长期创新上的平衡,不断提升企业研发、管理效率,为患者、医生、股东带去更大的回报。




